漆黃素,也叫非瑟酮,是一種天然的黃酮類化合物,最早于1833年從漆樹中分離提取得到,具有抗氧化、抗炎、抗腫瘤、抗衰老等作用[1]。
一、抗氧化利器與炎癥殺手
1966年,一篇發表在《Nature》上的文章表示漆黃素是當時已知抑菌效果最強的黃酮類物質之一,僅需要50μg/ml就可以有效抑制金黃葡萄球菌等細菌的生長[2],這引起了科學家們對漆黃素藥理作用的關注。在對漆黃素的后續研究中,科學家發現了它具有抗氧化和抗炎等作用。
漆黃素作為黃酮類物質天生自帶抗氧化屬性,不僅具有直接的抗氧化活性,還能提高細胞內主要抗氧化劑谷胱甘肽的水平[3]。即使是在氧化應激的情況下,漆黃素也能很好地維持線粒體功能[4],連非常脆弱的神經元細胞都能得到良好的保護。
除了自帶抗氧化天賦,它的抗炎效果也不容小覷。漆黃素通過激活β-catenin蛋白和沉默TLR4的表達來抑制NF-κB促炎信號通路[5][6],進而下調了炎癥細胞因子的釋放,達到抗炎的效果。
二、腫瘤的克星
對于強大的漆黃素來說,抗氧化和抗炎其實算不了啥,都是基本操作,對抗腫瘤才是它的舞臺。漆黃素在腫瘤發展的各個階段均發揮著抑制作用,用它的“霹靂”手段將腫瘤治理地服服帖帖。
在腫瘤初期時,漆黃素可以干擾染色體的分離和促進DNA雙鏈的斷裂,從而降低其增殖速度[7]。在腫瘤快速生長期時,漆黃素也能通過抑制uPA(尿激酶纖溶酶原激活物)來減少血管的生成,切斷腫瘤的營養來源 [8]。在腫瘤的晚期時,腫瘤可能會發生轉移,而漆黃素能通過抑制MMP-1這個關鍵靶點來阻止ECM蛋白屏障的降解,從而防止腫瘤細胞進入血液,抑制腫瘤細胞的轉移 [9]
三、延緩衰老
影響人類健康與長壽的不僅僅有癌癥,還包括衰老。漆黃素也不僅僅只滿足于抑制腫瘤的現狀,還想著在延緩衰老方面作出一番貢獻。
2007年,辛克萊等人發現了漆黃素可以激活SIRT1長壽蛋白[10],漆黃素才在抗衰老界嶄露頭角。2015年James Kirkland博士提出的Senolytics概念之后[11],漆黃素因其強大的清除衰老細胞能力成為了熱門的Senolytics物質,引起了更多的關注,。
漆黃素發揮其強大的抗衰能力主要依賴兩點,一個作為熱量限制模擬物,另一個則是作為Senolytics物質。
(1)熱量限制模擬物
熱量限制(CR)雖然延緩衰老效果顯著,但是實行起來有些痛苦并且見效也慢,這讓大多數人望而卻步,而熱量限制模擬物(CRM)完美地解決了這一點,它既能模擬CR,激活相應的信號通路,又不必降低熱量攝入[12]。
漆黃素作為一種熱量限制模擬物,通過上調Sirtuins家族中SIRT1的表達,進而抑制mTOR,從而誘導自噬[13]。與其他熱量限制模擬物如二甲雙胍不同,漆黃素具有組織特異性,對腦細胞的促進自噬效果更好[14]。
(2)Senolytics物質
Senolytics指的是靶向清除衰老細胞。隨著人年齡的增大,衰老細胞會不斷地積累,并且分泌出大量SASP(衰老相關分泌表型),促使周圍正常細胞走向衰老,從而加速機體的衰老[15]。
2018年的一篇研究顯示,漆黃素在當時的10種黃酮類物質中清除衰老細胞效果最好,其效果超過白藜蘆醇、姜黃素、兒茶素[16],因此成為科學家研究的重點對象。另一項研究表明漆黃素在清除了患有新冠的老年小鼠的衰老細胞后,其死亡率從原先的接近100%降低至50%[17]。
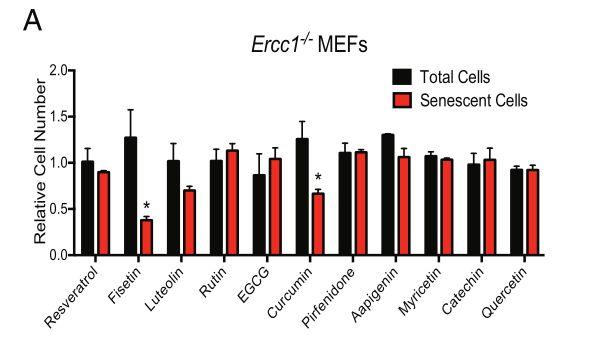
圖注:10種黃酮類物質清除衰老細胞的效果圖
那么漆黃素這么優秀的清除效果是如何做到的呢?研究發現,衰老細胞之所以不凋亡,很重要的一點是它們上調了SCAP網絡(抗凋亡途徑)[18],而漆黃素正是通過阻斷PI3k/Akt/mTOR 通路和激活SIRT1來阻斷SCAP網絡(抗凋亡途徑),從而使得衰老細胞自動走向凋亡[19]。
漆黃素作為一種天然的Senolytics物質,目前已在小鼠模型和人體組織中證實了其有效性和安全性。在臨床方面,漆黃素目前主要應用于關節炎、骨質疏松、新冠肺炎等適應癥,其臨床進展大都集中在二期[20],預計大部分臨床的結果會在今年下半年出爐。
參考文獻
[1] Shafique, A., Akram, S., & Mushtaq, M. (2021). Fisetin: A senolytic drug. In A Centum of Valuable Plant Bioactives (pp. 379-401). Academic Press. https://doi.org/10.1016/B978-0-12-822923-1.00002-9
[2] Gabor, M., & Eperjessy, E. (1966). Antibacterial effect of fisetin and fisetinidin. Nature, 212(5067), 1273-1273. https://doi.org/10.1038/2121273a0
[3] Khan, N., Syed, D. N., Ahmad, N., & Mukhtar, H. (2013). Fisetin: a dietary antioxidant for health promotion. Antioxidants & redox signaling, 19(2), 151-162. https://doi.org/10.1089/ars.2012.4901
[4] Maher, P. (2009). Modulation of multiple pathways involved in the maintenance of neuronal function during aging by fisetin. Genes & nutrition, 4(4), 297. https://doi.org/10.1007/s12263-009-0142-5
[5] Molagoda, I. M. N., Jayasingha, J. A. C. C., Choi, Y. H., Jayasooriya, R. G. P. T., Kang, C. H., & Kim, G. Y. (2021). Fisetin inhibits lipopolysaccharide-induced inflammatory response by activating β-catenin, leading to a decrease in endotoxic shock. Scientific reports, 11(1), 1-17.
https://doi.org/10.1038/s41598-021-87257-0
[6] Jiang, K., Yang, J., Xue, G., Dai, A., & Wu, H. (2021). Fisetin ameliorates the inflammation and oxidative stress in lipopolysaccharide-induced endometritis. Journal of Inflammation Research, 14, 2963. https://doi.org/10.2147/JIR.S314130
[7] Olaharski, A. J., Mondrala, S. T., & Eastmond, D. A. (2005). Chromosomal malsegregation and micronucleus induction in vitro by the DNA topoisomerase II inhibitor fisetin. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 582(1-2), 79-86. https://doi.org/10.1016/j.mrgentox.2005.01.002
[8] Jankun, J., Selman, S. H., Aniola, J., & Skrzypczak-Jankun, E. (2006). Nutraceutical inhibitors of urokinase: potential applications in prostate cancer prevention and treatment. Oncology reports, 16(2), 341-346. https://doi.org/10.3892/or.16.2.341
[9] Choudhury, R., Dunk, C., Lye, S., Aplin, J., Harris, L., & Jones, R. (2017). Decidual leukocytes are rich source of MMPs and capable of degrading ECM. Placenta, 57, 310-311. https://doi.org/10.1016/j.placenta.2017.07.273
[10] Yang, H., Baur, J. A., Chen, A., Miller, C., & Sinclair, D. A. (2007). Design and synthesis of compounds that extend yeast replicative lifespan. Aging cell, 6(1), 35-43. https://doi.org/10.1111/j.1474-9726.2006.00259.x
[11] Kirkland, J. L., & Tchkonia, T. (2015). Clinical strategies and animal models for developing senolytic agents. Experimental gerontology, 68, 19-25. https://doi.org/10.1016/j.exger.2014.10.012
[12] Saraswat, K., & Rizvi, S. I. (2017). Novel strategies for anti-aging drug discovery. Expert opinion on drug discovery, 12(9), 955-966. https://doi.org/10.1080/17460441.2017.1349750
[13] Singh, S., Singh, A. K., Garg, G., & Rizvi, S. I. (2018). Fisetin as a caloric restriction mimetic protects rat brain against aging induced oxidative stress, apoptosis and neurodegeneration. Life sciences, 193, 171-179.
https://doi.org/10.1016/j.lfs.2017.11.004
[14] Fisetin improves lead-induced neuroinflammation, apoptosis and synaptic dysfunction in mice associated with the AMPK/SIRT1 and autophagy pathway https://doi.org/10.1016/j.fct.2019.110824
[15] Gasek, N. S., Kuchel, G. A., Kirkland, J. L., & Xu, M. (2021). Strategies for targeting senescent cells in human disease. Nature Aging, 1(10), 870-879. https://doi.org/10.1038/s43587-021-00121-8
[16] Yousefzadeh, M. J., Zhu, Y. I., McGowan, S. J., Angelini, L., Fuhrmann-Stroissnigg, H., Xu, M., ... & Niedernhofer, L. J. (2018). Fisetin is a senotherapeutic that extends health and lifespan. EBioMedicine, 36, 18-28. https://doi.org/10.1016/j.ebiom.2018.09.015
[17] https://med.umn.edu/news-events/preclinical-study-suggests-new-approach-reduce-covid-19-death-among-elderly
[18] Mohtar, N., Taylor, K. M., Sheikh, K., & Somavarapu, S. (2017). Design and development of dry powder sulfobutylether-β-cyclodextrin complex for pulmonary delivery of fisetin. European Journal of Pharmaceutics and Biopharmaceutics, 113, 1-10. https://doi.org/10.1016/j.ejpb.2016.11.036
[19] Wissler Gerdes, E. O., Zhu, Y., Tchkonia, T., & Kirkland, J. L. (2020). Discovery of Senolytics and the Pathway to Early Phase Clinical Trials. In Senolytics in Disease, Ageing and Longevity (pp. 21-40). Springer, Cham. https://doi.org /10.1007/978-3-030-44903-2_2







